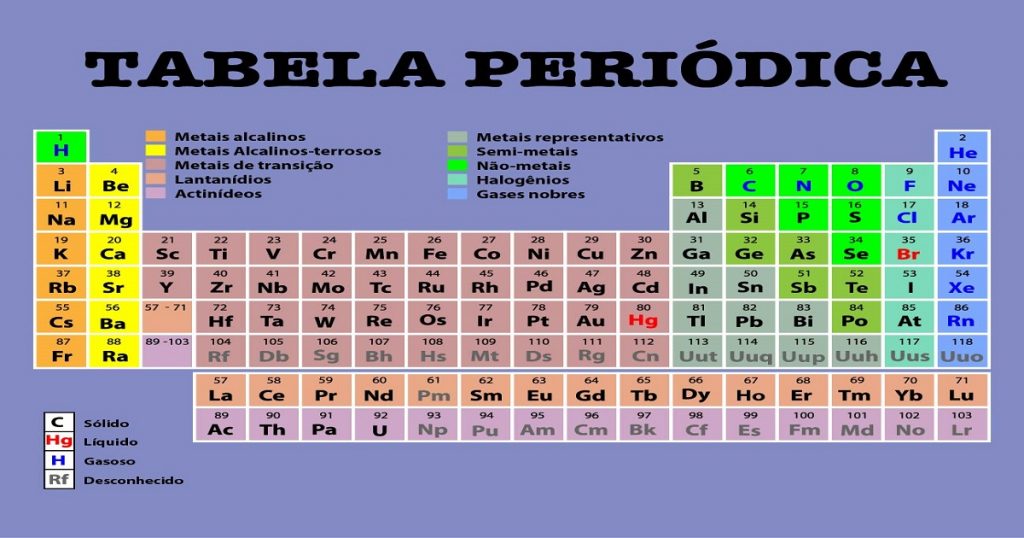
A tabela periódica surgiu com a necessidade que os químicos tinham de organizar sistematicamente os elementos químicos, procurando fornecer o máximo de informações, de forma que pudessem ser facilmente consultados por qualquer pessoa.
Trata-se nada mais do que uma disposição sistemática dos elementos químicos, com o objetivo de representá-los com suas propriedades de forma didática. É muito importante e amplamente utilizada nas disciplinas de química e ciências.
Foi Dimitri Mendeleev , que no ano de 1869, iniciou os estudos referentes a disposição dos elementos químicos. Foi trabalhando com os 60 elementos conhecidos até então, que ele percebeu que existia uma variável periódica.
As previsões de Dimitri Mendeleev em relação ao que seria a futura tabela periódica de Mendeleev se mostraram corretas. Onde passou a ser a tabela periódica utilizada para entender a sistematização dos elementos e suas propriedades.
Cada elemento químico possui um número atômico que acaba por ser denominado por Z, que representa o número de prótons presentes em seu núcleo. É através do número atômico que em ordem crescente os elementos químicos são listados.
Existem ainda o conceito de período e grupos, que dependem da camada eletrônica e da configuração eletrônica que serão detalhados adiante na sistematização da tabela periódica.
Basicamente os períodos são definidos por níveis ocupados por elétrons, e os grupos são definidos pela quantidade de elétrons presentes em uma subcamada. Ou seja, elementos que estão na mesma coluna apresentam propriedades químicas semelhantes.
Dos 118 elementos que existem, apenas 94 ocorrem naturalmente, sendo os outros 24 apenas sintéticos. Outra informação importante, é que entre esses 94 elementos que ocorrem naturalmente, apenas 84 são fundamentais os outros 10 ocorrem por decaimento radioativo.
Qual é a história da Tabela Periódica?
A história da tabela periódica começou no século XVIII com Antoine Lavoisier, quando o mesmo publicou uma lista com 33 elementos químicos, que incentivou os químicos do século XIX a estabelecer uma estruturação mais precisa.
Foi descoberto que muitos elementos poderiam ser agrupados em grupos com base em suas propriedades. Assim como, se organizados por peso atômico teriam um comportamento periódico.
Mais tarde em 1869, foi publicada uma tabela com cerca de 49 elementos organizados de acordo com a sua valência, de acordo com os conceitos de August Kekulé. Demonstrando que os elementos apresentavam propriedades semelhantes e podiam partilhar a valência.
Foi quando o professor russo Dimitri Mendeleev publicou sua sistematização dos elementos químicos. Que dispunha os elementos em períodos e grupos em ordem crescente do número atômico.
Sua tabela se tornou um sucesso, pois Mendeleev percebeu que existia uma tendência periódica dos elementos.
Mendeleev também tomou a importante decisão de deixar lacunas em aberto em seu modelo de tabela periódica. Isto porque, muitas vezes o elemento correspondente a lacuna poderia não ter sido descoberto.
Mais tarde, essas lacunas foram preenchidas quando se descobriram outros elementos tais como o Gálio, Germânio e o Frâncio.
Como funciona a sistematização da Tabela Periódica?
A tabela de Mendeleev é estruturada respeitando a ordem crescente dos números atômicos de cada elemento químico. Desta forma, são divididos em períodos e grupos.
Cada elemento é representado na tabela periódica por um símbolo, número atômico e de massa correspondente.
Períodos
Existem as colunas horizontais da tabela periódica, que são correspondentes aos períodos. Existem 7 períodos que indicam a quantidade de níveis de energia presentes nos átomos de cada elemento químico.
Grupos
Há também as colunas verticais que correspondem aos grupos (ou famílias), que totalizam 18, e podem ser divididas em grupos A e B. Existem 8 grupos A dos elementos representativos e 8 grupos B dos elementos de transição.
Por apresentarem mais aspectos periódicos relevantes do que os períodos e blocos, são frequentemente utilizados para definir melhor a propriedade dos elementos presentes em um mesmo grupo.
Blocos
Os blocos são definidos como um conjunto de elementos que possuem o elétron de mais alta energia. São reconhecidos como uma sequência na qual as camadas eletrônicas de um elemento são preenchidas. Existem 4 blocos principais: s, p, d e f.
O bloco S por exemplo compreende os grupos de metais alcalinos e alcalinos terrosos, bem como o hidrogênio e o hélio.
O bloco P compreende seis grupos que corresponde a todos os semimetais.
O bloco D compreende dez grupos que corresponde aos metais de transição.
O bloco F corresponde os lantanídeos e actinídeos.
Classificação dos elementos químicos
A classificação dos elementos químicos é feita de acordo com as suas propriedades químicas e físicas, e são categorizados em metais, semimetais e ametais (+Gases Nobres).
Os metais são conhecidos por suas características de ser um bom condutor, serem sólidos (exceto o mercúrio, em condições normais de temperatura e pressão), e também por apresentarem maleabilidade e ductilidade.
Os semimetais ou metalóides são designados como elementos que possuem características de metais e ametais. São conhecidos por serem maus condutores e por poderem assumir qualquer estado físico nas condições normais de temperatura e pressão.
Os ametais são todos os elementos que não se comportam como um metal ou semimetal.
Como mencionado anteriormente podem ser categorizados em elementos representativos representados pelo grupo A ou de transição representado pelo grupo B.
Os elementos representativos podem ser entendidos como todos aqueles que possuem subníveis de energia completos. Os participantes desta classe são os grupos de IA a VIIIA.
Já os elementos de transição são os que possuem subníveis de energia incompletos, e estão localizados entre os grupos IIA e IIIA. Os participantes desta classe são os grupos de IB a VIIIB.
Propriedades dos elementos químicos
É possível definir algumas propriedades dos elementos químicos com a tabela periódica. Tais como: o raio atômico, a energia de ionização, eletronegatividade, eletropositividade e reatividade.
O raio atômico é uma propriedade referente ao tamanho dos átomos de um elemento, e varia de forma previsível. Naturalmente o raio atômico cresce da direita para a esquerda, e de cima para baixo na tabela periódica.
Já a energia de ionização quantifica a energia necessária para a retirada de elétrons de um átomo no estado gasoso, e aumenta da direita para a esquerda na tabela periódica. Isto porque, quanto menor o raio atômico maior é a energia de ionização.
A eletronegatividade mede a tendência de um átomo de atrair os elétrons. É uma propriedade que é principalmente afetada pelo número atômico e pela distância entre os elétrons.
Normalmente, a eletronegatividade tende a aumentar da esquerda para a direita e de baixo para cima, ou seja, quanto maior o raio atômico maior a eletronegatividade.
A eletropositividade é uma propriedade capaz de determinar o caráter metálico, e está relacionada a tendência de um átomo de perder elétrons.
Assim como as outras propriedades, se relaciona diretamente com a propriedade de raio atômico. Quanto menor for o raio atômico menor a sua eletropositividade, ou seja, a eletropositividade cresce da direita para a esquerda e de cima para baixo na tabela periódica.
A reatividade está relacionada com a tendência que um determinado elemento químico tem em reagir. Trata-se de um conceito bastante qualitativo, medindo a tendência que um átomo possui em capturar ou perder elétrons.
Os valores para reatividade tendem a ser diferentes entre os metais e os não metais. Mas, normalmente a maior reatividade está relacionada a menor nobreza do material, ou seja, os metais alcalinos e alcalinos terrosos.
A tabela periódica surge então em uma tentativa de organizar e sistematizar os elementos químicos, que podem apresentar propriedades químicas e físicas semelhantes, de forma que facilite sua localização e compreensão.
É através dela que se torna possível conhecer tudo sobre um determinado elemento. Desde número atômico, massa, distribuição eletrônica a todas as suas propriedades periódicas. Por isso, é muito importante conhecer e entender a tabela periódica!
Tabela Periódica: Definição, Números e Períodos – Extensivo Química
Veja mais em: Ferramentas para te ajudar nos estudos em casa
Tabela Periódica para imprimir
Tabela 01
Tabela 02
Tabela 03
Tabela 04